
MSB,eLife & Communications Biology三连发 | 跨尺度理论体系揭示微生物基因流动的核心定量规律
水平基因转移作为微生物进化与生态适应的核心驱动力,深刻影响着基因组结构、功能多样性及群落动态,深入解析这一过程的调控机制,将为合成生物学和微生物组工程提供突破性的研究工具与理论框架。
然而,该领域仍面临重大挑战:微生物间通过质粒、转座子和噬菌体等载体形成的基因流动网络不仅结构复杂,更在生态演替过程中呈现动态变化特征。这种复杂性使得精确调控基因流动成为当前研究的难点,其根本原因在于我们对这一复杂过程的基本定量规律缺乏理性认知。
针对这一科学瓶颈,中国科学院深圳先进技术研究院定量合成生物学全国重点实验室、合成生物学研究所王腾研究员发表系列研究,构建了跨尺度研究体系:通过整合定量实验、计算模型和组学大数据,从个体细胞、单一群落、集合群落三个复杂度层次,时空两个维度,系统探索了水平基因转移的定量规律。这一多尺度研究框架为理解微生物基因流动提供了全新的理论基础和方法学支撑。
5月1日,王腾研究员课题组在Molecular Systems Biology上发表了题为"Spatial entropy drives the maintenance and dissemination of transferable plasmids"的研究论文。该工作首次将物理学中“熵”的概念引入微生物生态学,揭示了空间结构驱动基因水平转移的普适机制。
质粒作为可转移遗传元件,是抗生素耐药基因(ARGs)传播的主要载体,其扩散机制的研究对遏制耐药性爆发至关重要。经典理论基于均匀混合环境假设,提出质粒维持需高转移率阈值,但自然微生物群落普遍存在空间异质性(如生物膜、微塑料聚集),现有模型难以解释复杂环境中质粒的稳定性。传统理论预测与实际观测的差距(如自然质粒转移率常低于理论阈值)表明,空间结构对基因流动的影响尚未被充分解析,亟需建立整合空间异质性的理论框架。
本研究通过构建集合群落动力学模型,结合实验验证与基因组大数据分析,揭示空间熵(量化空间异质性的指标)对质粒传播的核心作用。理论模拟表明,空间熵越低(即空间异质性越高),质粒的扩散速度和全局维持能力越强。低熵环境通过增加局部细胞密度波动,提升了质粒的有效转移率,从而突破了经典理论预测的质粒维持阈值,使得低转移效率的质粒也能长期存在。在大肠杆菌的合成微生物群落中,人为调控空间熵(通过调整细胞密度分布)证实了低熵环境显著提高质粒传递效率。进一步分析34,688个原核基因组大数据发现,携带生物膜形成相关基因(BFGs,低熵环境标志)的原核生物基因组中,质粒、抗生素抗性基因(ARGs)、转座酶和毒素/抗毒素系统基因更丰富,验证了低熵环境促进可移动遗传元件(MGEs)的进化优势。
本研究首次将物理学“熵”概念引入微生物生态学,揭示了空间结构驱动基因水平转移的普适机制,挑战了均匀环境假设下的经典理论,为耐药性传播预测提供了新思路,推动生态学与进化理论的整合。实际应用中,提出通过调控环境熵(如破坏生物膜、减少微塑料污染)抑制ARGs扩散的策略,为公共卫生管理及微生物组工程提供了关键理论工具,为抗生素抗性管理提供新靶点(如干预生物膜形成)。此外,跨学科整合模型构建-实验-大数据的方法,为解析复杂生态系统中的进化动力学树立了范例。
3月3日,王腾课题组在eLife上发表了题为“Emergence of alternative stable states in microbial communities undergoing horizontal gene transfer”的研究论文。该工作基于多尺度微生物生态学模型,系统揭示了复杂微生物生态系统中多稳态的涌现机制。
微生物群落在相同环境中常呈现不同的稳定状态,但其多稳态的起源机制尚不明确。以往研究聚焦于物种互作和资源竞争,而水平基因转移(HGT)作为微生物进化的重要驱动力,其作用长期被忽视。HGT通过可移动遗传元件(MGEs)改变宿主生长速率和种间相互作用,可能重塑群落稳定性,然而HGT如何影响多稳态的形成仍缺乏系统性研究。理解这一机制对揭示微生物群落动态及调控具有重要意义。
本研究构建数学模型,结合数值模拟分析HGT对微生物群落稳定性的影响。结果显示,HGT通过促进物种间基因交流,显著增加两物种及多物种群落的稳态数量,尤其在生长速率相近且竞争激烈的物种中更为显著;MGEs的表型效应(如增强生长或改变竞争强度)决定HGT对多稳态的促进或抑制作用,正向表型效应扩大稳态区域,而负向效应削弱;在抗生素选择压力下,HGT使耐药基因扩散,创造新稳态;集合群落模拟表明局部多稳态通过空间异质性提升区域多样性。研究还探讨了稀释率、质粒互作等参数的影响,验证了模型的稳健性。
本研究首次系统揭示了HGT驱动微生物群落多稳态的机制,填补了生态与进化理论的空白。结果为预测群落状态转变(如肠道菌群失调)、设计微生物工程策略(如通过抑制HGT稳定有益群落)提供了理论依据。同时,阐明了局部多稳态对区域多样性的贡献,为生态保护和生物修复提供了新思路。这一框架将促进跨尺度微生物动态研究,助力精准调控复杂微生物系统。
此前不久,王腾团队在Communications Biology上发表了题为“The evolutionary landscape of prokaryotic chromosome/plasmid balance”的研究论文。该工作解析了原核生物染色体/质粒平衡的多层次选择机制,为质粒的演化动力提出了全新的理论框架。
质粒作为原核生物中广泛存在的可移动遗传元件,在微生物进化、抗生素抗性传播及病原毒力扩散中扮演核心角色。依据传统达尔文进化理论,质粒的存续依赖于宿主表型选择(如宿主生长负担的降低),但近年研究发现,非表型选择(如质粒自身复制效率、水平转移能力)同样显著影响其稳定性。例如,人类肠道中广泛存在的pBI143质粒虽无明确功能基因且面临强选择压力,挑战了传统表型选择范式。然而,现有研究多聚焦单一选择压力,对两种力量如何共同塑造染色体/质粒平衡缺乏系统性定量模型,尤其缺乏对代谢资源分配、宿主基因组规模等内在因素的动态解析。这一理论空白限制了对质粒多样性的进化解释,也阻碍了临床耐药基因传播的精准干预。
本研究构建了一个代谢通量模型,模拟染色体与质粒基因在细胞内资源竞争中的动态平衡。通过粗粒化随机网络和通量平衡分析,模型量化了表型选择(宿主生长负担)与非表型选择(质粒自我维持能力)的强度,揭示二者随质粒/染色体大小变化的权衡关系。模型预测了质粒进化中的“最优平衡点”,并通过分析NCBI数据库中15,713个含质粒的原核基因组数据验证:染色体增大推动质粒规模上限提升,而小质粒因非表型选择压力易被淘汰,与理论预测的进化景观一致。
该研究提出“多层次选择”理论框架,首次将表型与非表型选择的动态拮抗关系定量化,为质粒多样性起源提供了普适性解释。理论层面,模型揭示了原核生物基因组可塑性的进化边界,即染色体规模通过代谢网络复杂度调控质粒存续阈值,这为理解古菌-细菌质粒分布差异提供了新视角。实践层面,研究对临床控制耐药基因传播(如优化质粒干预策略)和合成生物学(如设计稳定工程质粒)具有应用价值。此外,研究强调代谢网络复杂度对质粒动态的影响,为评估病原菌风险提供了新思路。
中国科学院深圳先进技术研究院的博士后薛文智(MSB共同一作,Communications Biology一作)和研究助理洪居恳(MSB共同一作,eLife一作)为系列论文的第一作者。这些研究获得了科技部合成生物学重点研发计划,国家自然科学基金面上项目,青年项目,深圳合成生物学创新研究院科研计划等多个项目的支持。

文章上线截图
文章链接:https://doi.org/10.1038/s44320-025-00110-8
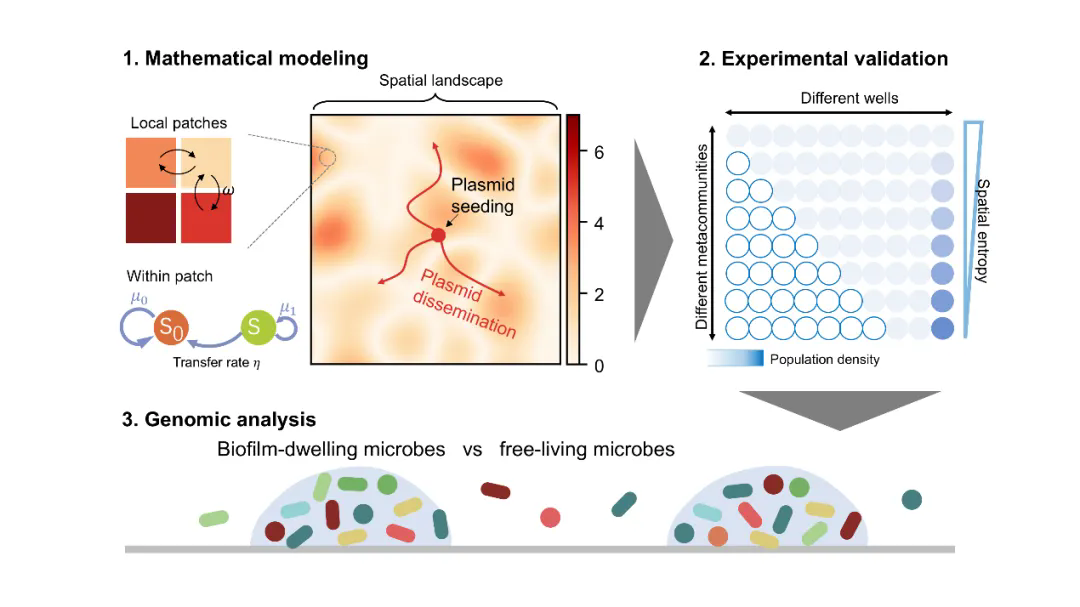
图1 本工作的核心研究思路

文章上线截图
文章链接:https://doi.org/10.7554/eLife.99593.3
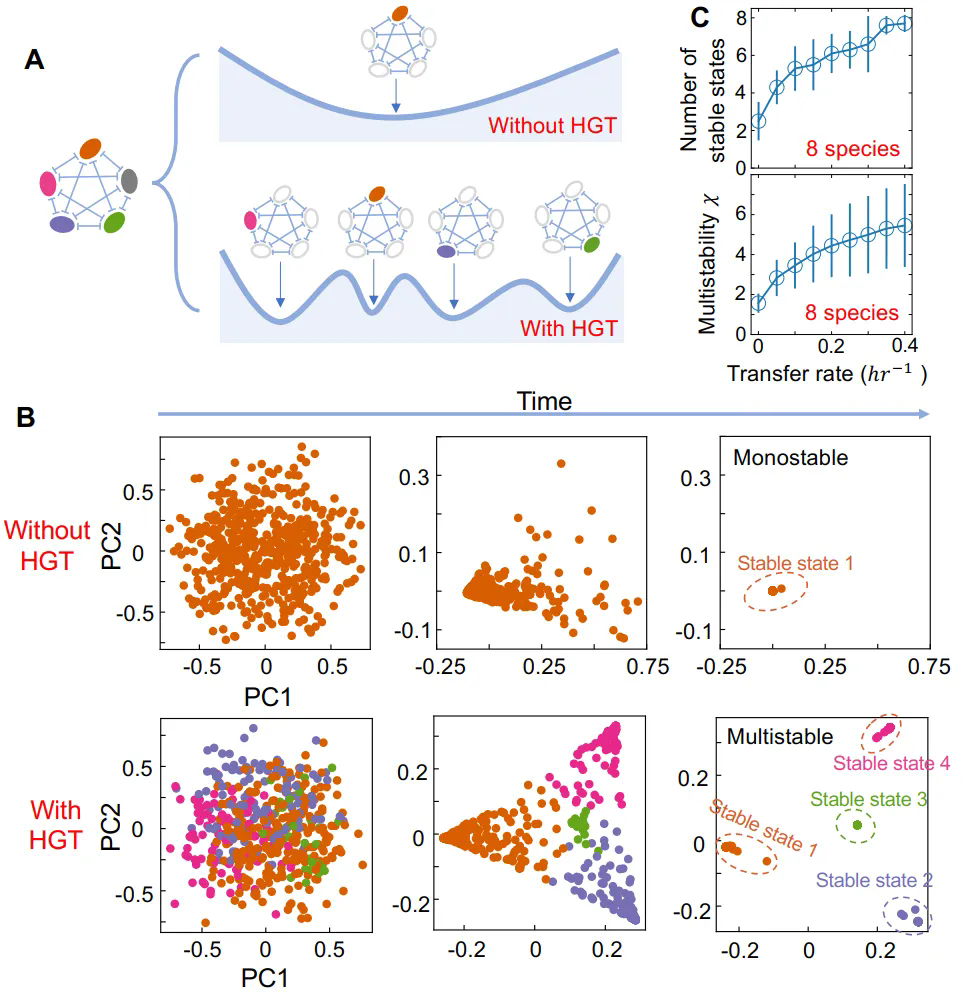
图2 水平基因转移促进群落多稳态的涌现

文章上线截图
文章链接:https://www.nature.com/articles/s42003-024-07167-5
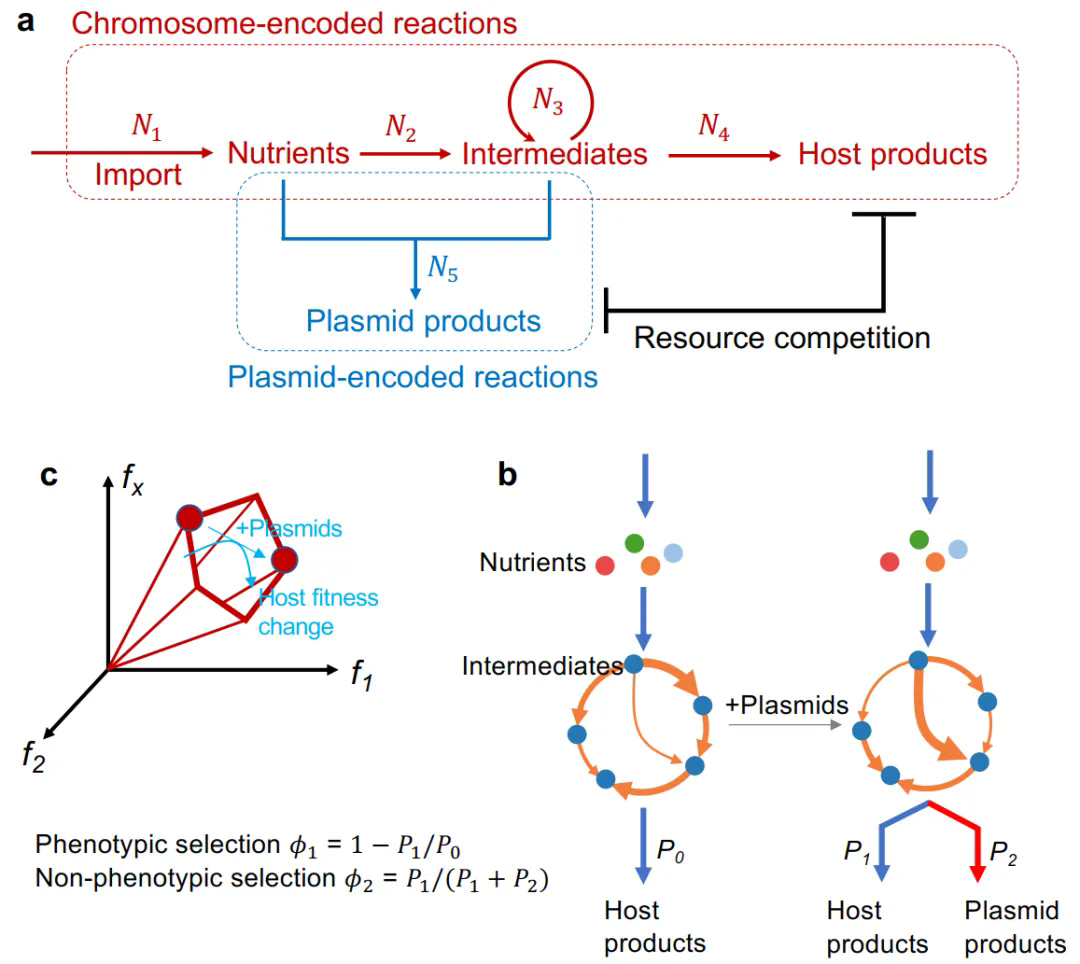
图3 染色体与质粒基因在细胞内资源竞争与动态平衡理论
附件下载: