
Mol Psychiatry丨揭示神经免疫信号直接调控多巴胺神经元及尼古丁成瘾机制
近日,中国科学院深圳先进技术研究院脑认知与脑疾病研究所/深港脑科学创新研究院陈祖昕、刘欣安团队联合多家国内外机构,在 Molecular Psychiatry 发表题为“Interleukin 13 signaling modulates dopaminergic functions and nicotine reward in rodents” 的研究论文。研究首次系统揭示了免疫炎症因子白细胞介素-13(IL-13)及其受体对中脑多巴胺神经元活动的直接调控作用,并鉴定PI3K/AKT-HCN 离子通道为其关键下游信号通路。团队发现,IL-13 能抑制尼古丁对多巴胺神经元的兴奋效应,并显著降低尼古丁自给药行为。这一发现不仅揭示了免疫炎症因子在奖赏及成瘾行为中的重要作用及关键分子靶点,也为解释急性疾病(如重感冒)后部分吸烟者吸烟量下降甚至成功戒烟的现象提供了潜在机制。 此外,研究还发现内源性IL-13定位于神经元突触前膜的囊泡中,提示其可能通过突触囊泡释放,发挥类似“神经调质”的作用,为理解脑内多种炎症因子的神经功能提供了新范式。
近十余年来,神经—免疫互作(neuroimmune interaction)逐渐被认为是调控脑功能和行为状态的重要机制之一。免疫系统不仅通过外周炎症反应影响身体健康,还能通过细胞因子(cytokines)、趋化因子(chemokines)等信号分子作用于中枢神经系统。在成瘾领域,越来越多证据表明,药物滥用会激活外周及中枢的免疫反应,改变小胶质细胞和星形胶质细胞的活化状态,释放多种炎症因子,从而重塑奖赏环路的功能。然而,目前研究主要关注胶质细胞介导的间接作用,对于炎症因子对神经元的直接调控作用及其在成瘾行为中的角色仍知之甚少。此外,既往研究发现,吸烟人群在感染等急性疾病期间往往会减少吸烟量,但背后的神经机制不明。由于尼古丁成瘾的核心机制依赖中脑腹侧被盖区(VTA)多巴胺神经元的兴奋,研究团队推测,脑内免疫因子可能通过直接调节这些神经元的活性来影响成瘾行为。本研究工作针对以上科学问题进行了深入探讨。
首先,研究团队利用中脑多巴胺神经元的单细胞核测序,系统分析了该类神经元中主要免疫炎症因子受体的表达谱,发现 IL-13Rα1和IL-4R 的表达量最高。进一步通过IL-13Rα1与TH的免疫染色,并结合Allen Brain Atlas 的原位杂交数据,确认在全脑范围内,IL-13Rα1 仅特异性表达于中脑多巴胺神经元(图 1)。
随后,研究团队利用免疫电镜技术分析了腹侧被盖区(VTA)内源性 IL-13 的分布,意外发现 IL-13 存在于神经元突触前膜,尤其富集于接近活性区(active zone)的突触囊泡中。急性脑片电生理记录结合IL-13-Cre::Ai32转基因小鼠的特异性光遗传激活实验表明,激活VTA区IL-13阳性神经纤维可显著抑制多巴胺神经元的放电活动。外源性灌流IL-13同样产生抑制作用,且该效应依赖 IL-13Rα1 受体(图 2)。
鉴于 VTA 多巴胺神经元在成瘾行为中的核心作用,研究团队进一步探讨了 IL-13 及其受体对尼古丁成瘾行为的影响。利用 DAT-Cre::AI38 小鼠结合双光子成像技术,首先证实 IL-13 可抑制多巴胺神经元的钙信号活动;尼古丁可显著增强该钙活动,但这一效应可被 IL-13 阻断。电生理记录进一步验证,IL-13 能抑制尼古丁对多巴胺神经元兴奋性的促进作用。行为学与药理学实验显示,向 VTA 局部灌注 IL-13 可显著减少大鼠对尼古丁的静脉自给药行为,而对自主取食行为无显著影响;相反,IL-13Rα1 基因敲除则导致小鼠显著增加尼古丁的自我摄取量(图 3)。这些结果表明,IL-13系统可特异性干预尼古丁成瘾行为。
研究团队进一步阐明了IL-13/IL-13Rα 受体作用的下游机制。急性脑片电生理记录及双光子成像结果显示,IL-13 通过抑制HCN通道(超极化激活环核苷酸门控阳离子通道)降低多巴胺神经元的兴奋性。作为一种常见的外周II型免疫因子受体,IL-13Rα通常经JAK/STAT激酶通路发挥作用,尤其在过敏性气道反应中具有重要作用。然而,本研究发现IL-13并未显著改变VTA组织中JAK/STAT的水平,而是显著上调了 PI3K/AKT的磷酸化水平。进一步地,特异性激酶抑制剂阻断了 IL-13 对多巴胺神经元活动及尼古丁成瘾行为的调控作用(图 4)。这些结果表明,IL-13/IL-13Rα受体主要通过PI3K/AKT–HCN通道信号轴实现对多巴胺神经元及成瘾行为的调控。
综上,本研究揭示了IL-13Rα1 受体作为多巴胺神经元中最为丰富的免疫炎症因子受体之一,在调控多巴胺神经元活动与功能中发挥重要作用(图5)。主要创新包括:1)首次发现存在于神经元内的 IL-13(而非传统观点认为仅存在于胶质细胞中),并提示其可能以突触囊泡释放的方式发挥类神经递质功能,为阐释脑内多种炎症因子的作用机制提供了新范式。2)明确了免疫炎症因子可通过多巴胺神经元直接调控尼古丁成瘾行为(而不仅仅影响髓鞘完整性或诱发神经毒性),为解释吸烟者在急性疾病发作后(如重感冒)吸烟量减少及戒烟成功率提高的潜在机制提供了新证据。未来,靶向 IL-13/IL-13Rα1 信号通路有望成为戒烟及其他药物成瘾干预的新策略。
深圳先进院脑所/深港脑院陈祖昕为论文的最后通讯作者;Scripps研究所Bruno Conti教授为共同通讯作者;深圳先进院脑所/深港脑院刘欣安为第一作者;深圳先进院/深港脑院为第一单位。研究论文的共同作者还包括助理研究员任嘉彦、研究助理杨其兴、汪金桃、徐智彬、史萃菡等成员,迈阿密大学Luis Tuesta教授团队及其成员,深圳先进院脑所王立平研究员、蔚鹏飞研究员及团队成员,北京大学深圳研究生院李书鹏教授及郭洪岭博士,中南民族大学阳小飞教授及团队成员,和广州南方学院夏建勋教授等。陈祖昕/刘欣安合作团队长期致力于尼古丁及相关产品的精神及生理效应研究,欢迎对该领域感兴趣的研究生、博士后、科研人员加入。
该研究致谢了科技部科技创新2030 “脑科学与类脑研究”重大项目、国家自然科学基金委员会、广东省基础与应用基础研究基金委员会、广东省脑连接图谱重点实验室、深圳市科创委、深港脑科学创新研究院、深圳市药物成瘾重点实验室等项目的资助与支持。

文章上线截图
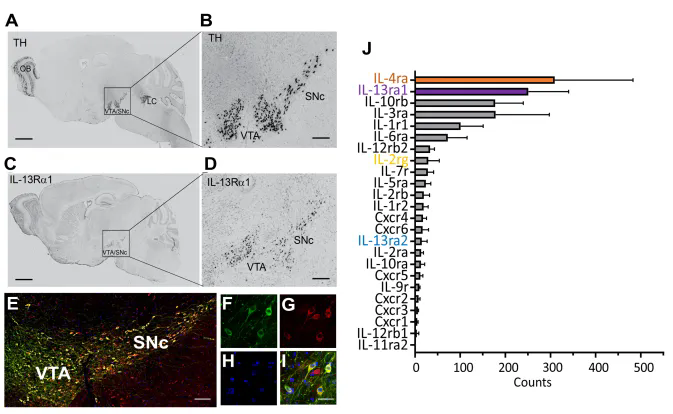
图1. IL-13Rα1受体只特异性地在多巴胺神经元中表达,并且是该类神经元中表达量最高的免疫受体之一
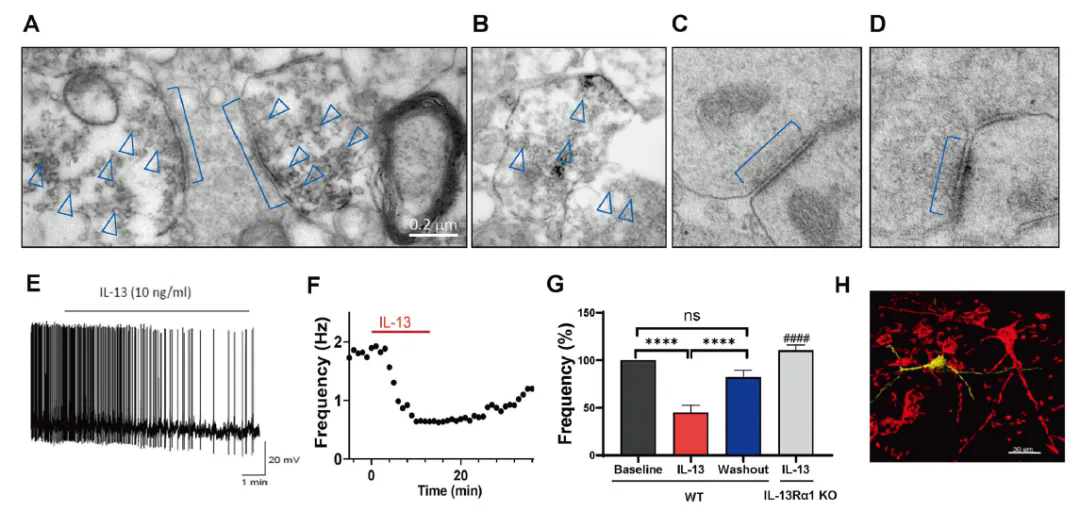
图2. 内源性IL-13可存在于神经元突触前膜囊泡中,内源性激活IL-13神经末梢或者外源性给予IL-13均可显著抑制多巴胺神经元活动
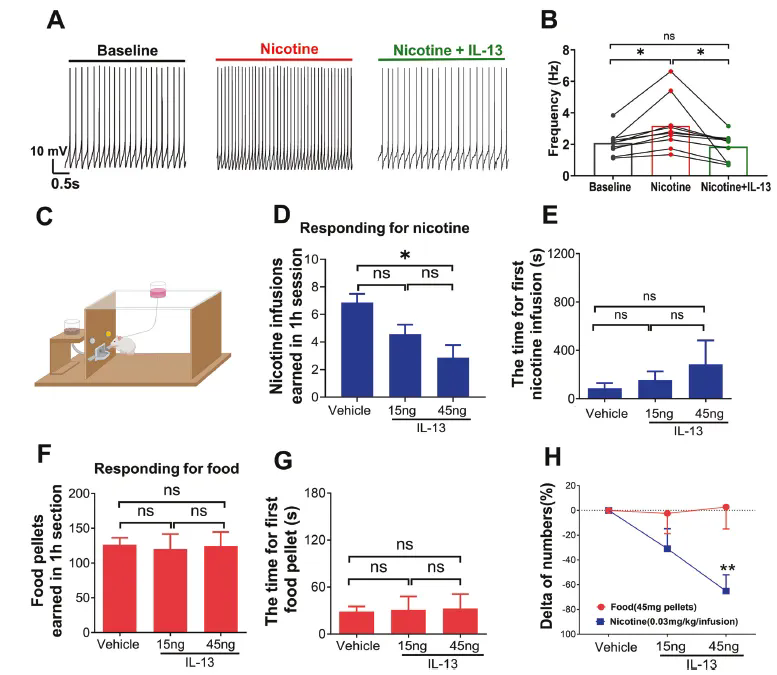
图3. IL-13可显著削弱尼古丁对多巴胺神经元的兴奋作用,并且显著干预大鼠尼古丁静脉自给药行为
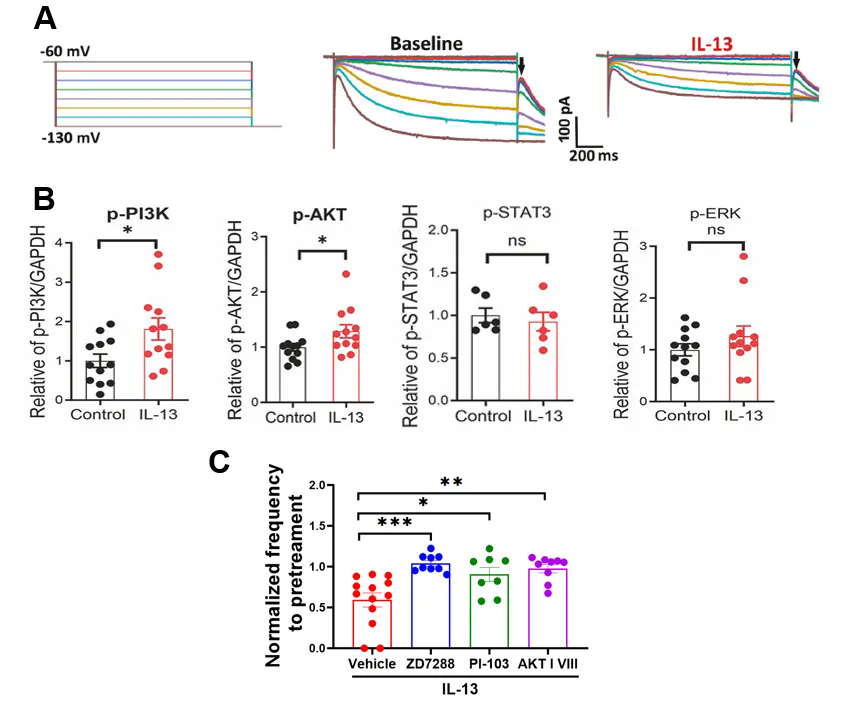
图4. IL-13对多巴胺神经元活动及功能的抑制作用依赖于AKT/PI3K和HCN通道
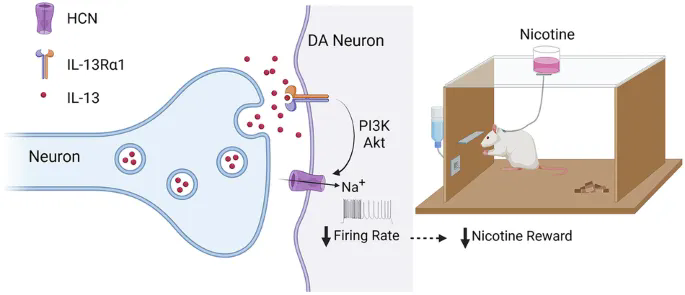
图5. IL-13可作为一种囊泡释放的“神经调质”,通过突触后IL- 13Ra1受体及相关信号通路, 对多巴胺神经元及尼古丁成瘾行为起到显著的调控作用

陈祖昕/刘欣安及团队成员合影(任嘉彦、杨其兴、汪金桃、陈淑敏、徐智彬、史萃菡、王若曦、张胜、黄雨欣)
附件下载: