
Commun Biol & J Pathol Clin Res | 定量解析肿瘤微环境——探究杀伤性T淋巴细胞运动模式与肿瘤内细胞空间分布特征
研究背景与意义
肿瘤微环境是一个高度异质的复杂系统,除癌细胞外,还包含免疫细胞、基质细胞等多种非癌细胞。它们在空间上的分布及其相互作用,不仅塑造了肿瘤的发生发展过程,也深刻影响了患者对治疗的响应。近年来,免疫治疗在部分癌症中取得积极进展,但在多数实体瘤中,仍面临免疫细胞浸润受限和局部免疫抑制等难题,严重制约了其疗效的进一步提升。因此,定量解析组织切片中的细胞空间分布信息、深入理解免疫细胞的运动行为特征等,是推动实体瘤精准诊疗的重要方向。
随着活细胞成像、转录组测序和深度学习等技术的快速发展,研究者开始从空间分布和时空动态两个层面,定量刻画肿瘤微环境中的细胞空间分布与功能。然而,当前研究仍面临两大挑战:一是尽管已有研究利用深度学习解构病理图像中细胞的类型与空间位置,但领域内尚缺乏可解释、可量化的细胞空间分布特征以定量刻画肿瘤微环境并建立其与肿瘤进展之间的关联;二是尽管已有研究揭示了杀伤性T淋巴细胞的运动特征,但对其与癌细胞相互作用过程中的运动行为的模式变化以及二者共演化机制的理解仍不清晰。
针对上述问题,中国科学院深圳先进技术研究院定量合成生物学全国重点实验室/合成生物学研究所李雪飞研究员团队,联合北京医院/国家老年医学中心、松山湖材料实验室等多家临床与科研单位,分别从免疫细胞的时空动态行为与组织病理图像的空间结构两个维度开展系统研究,通过实验/临床数据定量分析与物理建模相结合的方法,一方面在体外构建的肿瘤微环境中,系统揭示了抗原特异性T细胞在共培养条件下的导航策略与肿瘤细胞免疫逃逸机制(发表于Communications Biology),另一方面,利用深度学习所识别出的细胞类型与空间位置,定义并发现了对肝癌患者病情进展具有预测价值的肿瘤空间生物标志物(发表于The Journal of Pathology: Clinical Research)。相关研究为理解肿瘤微环境的演化规律、提升患者对于癌症治疗的响应等提供了理论与数据支撑。
一、揭示抗原特异性T细胞在肿瘤共培养环境中的导航策略与肿瘤免疫逃逸机制(Communications Biology)
7月31日,李雪飞研究团队联合松山湖材料实验室生物界面韩伟静副研究员、中国科学院物理研究所李明研究员在Communications Biology上发表了题为“Deciphering antigen-specific T cell navigation tactics and cancer immune evasion in co-cultures”的研究论文(图1)。该工作定量刻画了抗原特异性T细胞在多肿瘤团簇共培养环境中准二维平面上的运动行为,提出了T细胞运动和聚集的关键机制,并发现了癌细胞在与T细胞相互作用过程中逐步形成的免疫逃逸现象。
研究团队搭建了一个多癌团簇的2.5D体外共培养体系,结合活细胞延时成像、细胞轨迹定量分析、计算建模与转录组测序(包括bulk和单细胞RNA测序)(图2),系统地研究了肿瘤抗原特异性T细胞在肿瘤团簇周围的运动模式。
研究发现,相比于非特异识别组,抗原特异性T细胞在共培养条件下表现更长的癌细胞驻留时间(dwell time)(图3)和更强的运动方向持续性(directional persistence)。功能实验进一步表明,阻断CXCR3-CXCL9/10信号通路(使用拮抗剂ACT-660602)可显著削弱T细胞的方向持续性迁移能力,降低其在肿瘤团簇上的富集密度和杀伤效率。这一结果暗示该通路在调控T细胞迁移和抗肿瘤应答中具有潜在的干预价值。
此外,基于运动轨迹数据,研究团队建立了模拟T细胞运动模式的计算模型(图4),进一步验证了“方向性迁移+稳定接触”双机制对T细胞定位与聚集的关键作用。其中,T细胞较强的运动方向持续性有助于提高对肿瘤细胞的搜索效率;而与癌细胞形成的长时间接触(dwell time)是实现聚集的核心因素。
有趣的是,研究团队还发现部分存活的肿瘤细胞在T细胞攻击后发生了表型转变。通过bulk和单细胞转录组分析,研究识别出一类具有免疫逃逸特征的肿瘤细胞亚群(Cancer-C4):该亚群不仅显著下调趋化因子(如CXCL9/10)表达(图5),还激活上皮-间充质转化(EMT)相关通路,表现出更强的迁移性和免疫逃逸特征。
该研究结合实验与计算建模手段,系统阐明了抗原特异性T细胞在与肿瘤共培养环境中实现导航与聚集的行为机制,并揭示了癌细胞在T细胞攻击下诱导形成免疫抑制表型的动态过程。研究成果有望为“冷肿瘤”的形成机制提供新的视角,也为优化免疫细胞工程设计、提升免疫疗法在实体瘤中的穿透与杀伤效率提供了关键的时空行为学依据和潜在干预靶点。
二、利用深度学习构造并发现肝癌肿瘤细胞空间分布特征预后标志物(The Journal of Pathology: Clinical Research)
此前不久(6月13日),李雪飞研究团队联合北京医院宋京海教授、崔菊研究员团队在The Journal of Pathology: Clinical Research上发表了题为“Leveraging deep learning to discover interpretable cellular spatial biomarkers for prognostic predictions based on hepatocellular carcinoma histology”的研究论文(图6)。
该工作开发了一套基于深度学习的组织图像处理流程,构造了一系列细胞空间分布特征,系统识别并量化肝细胞癌(HCC)组织中多种细胞类型的空间分布特征,发现具备独立预后预测价值的空间生物标志物,为病理图像的结构解析和术后风险评估提供了新思路。
研究开发了端到端的图像处理流程(图7),结合深度学习分类器与图论方法(Delaunay三角与Voronoi图),从常规临床肿瘤切片(苏木素-伊红染色法)中识别肝癌组织内的肿瘤、免疫和基质细胞,并构建空间邻接网络,提取共计109种拓扑结构特征。
通过对公开数据库TCGA及北京医院两大患者队列的回顾性分析,研究最终筛选出鉴定出6种细胞空间特征与患者总体生存期显著相关。在采用一致的阈值时,这些空间特征在两个队列中均表现出显著的预后指示作用(图8),且部分特征的组合,如基质细胞周围的细胞多样性均值(StrDiv-M)、细胞间距离中位数(CellDis-MED)等,能够进一步优化患者的生存周期分层。
此外,研究显示,将细胞空间特征与临床特征如微血管侵犯结合(MVI),可以显著提升预后预测的准确性(图9)。这不仅为肝细胞癌的临床分层提供了新工具,也为深入理解肿瘤微环境细胞间复杂空间组织及其机制研究奠定基础。
相关成果未来有望推动精准肿瘤诊疗策略的制定,提升肝癌患者的临床管理水平。
结语
篇一(Communications Biology):中国科学院定量合成生物学重点实验室/合成生物学研究所李雪飞研究员、松山湖材料实验室生物界面团队韩伟静副研究员、中国科学院物理研究所李明研究员是本文的共同通讯作者。中国科学院大学硕士毕业生李新月、松山湖材料实验室工程师金桃丽与王丽莎为本文的共同第一作者。
篇二(The Journal of Pathology: Clinical Research):中国科学院定量合成生物学重点实验室/合成生物学研究所李雪飞研究员、北京医院/国家老年医学中心肝胆胰外科主任宋京海教授、北京医院/国家老年医学中心老年医学研究所崔菊研究员是本文的共同通讯作者。中国科学院定量合成生物学重点实验室/合成生物学研究所助理研究员胡汇涓博士、中国医学科学院北京协和医学院研究生院毕业博士生谭天华为本文的共同第一作者。
这两项研究分别从“免疫细胞行为机制”与“空间结构特征识别”两个角度出发,解析了肿瘤免疫微环境中细胞间相互作用的动态过程与组织结构的空间复杂性,展现了在定量病理、人工智能分析与细胞动力学研究方面的交叉融合能力。研究为免疫细胞导航与聚集机制的建模提供了定量依据(篇一),也为病理图像中空间结构信息的可解释提取与术后风险预测提供了计算工具与理论基础(篇二)。相关研究工作得到了国家重点研发计划、国家自然科学基金、中国科学院战略性先导科技专项、广东省重点领域研发计划、广东省基础与应用基础研究基金、中央高水平医院临床研究专项、广东省珠江计划高层次人才项目、深圳市科技计划与深圳合成生物研究院科研项目等项目支持。

图1 文章上线截图(全文链接:https://doi.org/10.1038/s42003-025-08568-w)
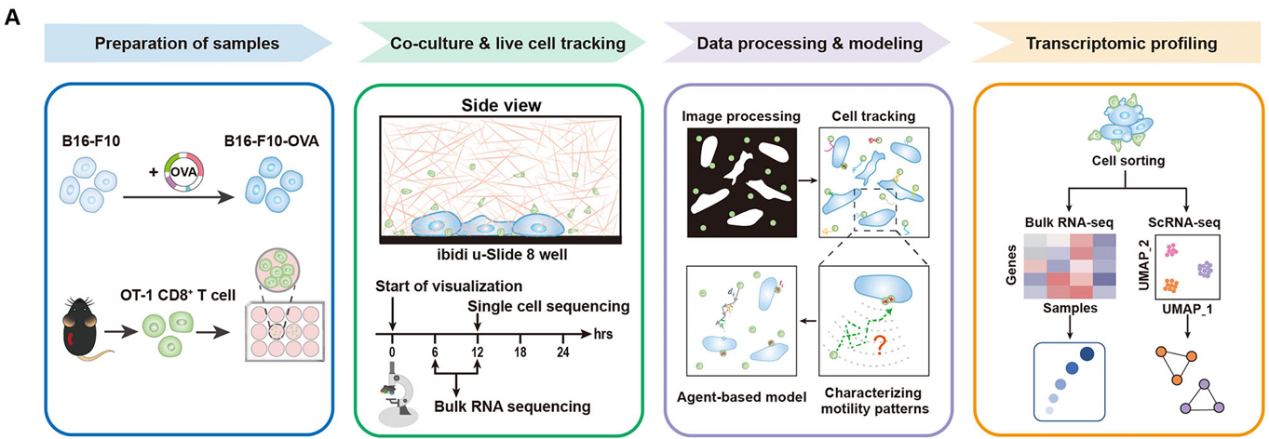
图2 研究分析流程概览
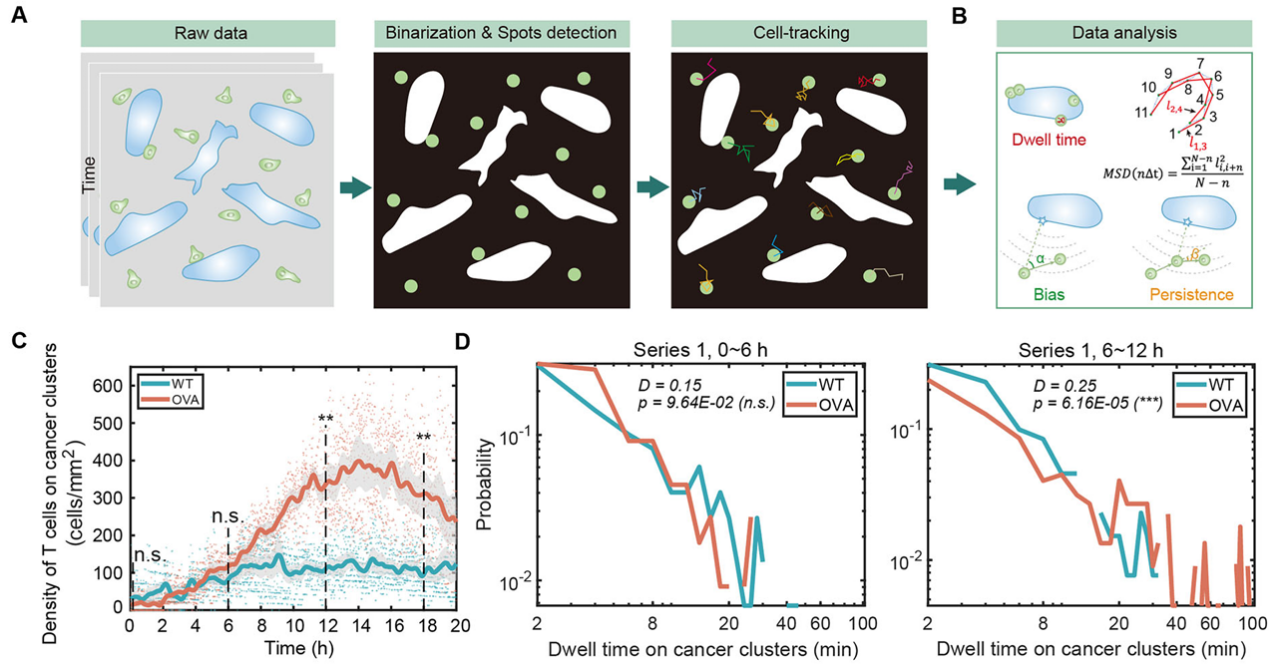
图3 定量解析共培养体系中T细胞运动模式
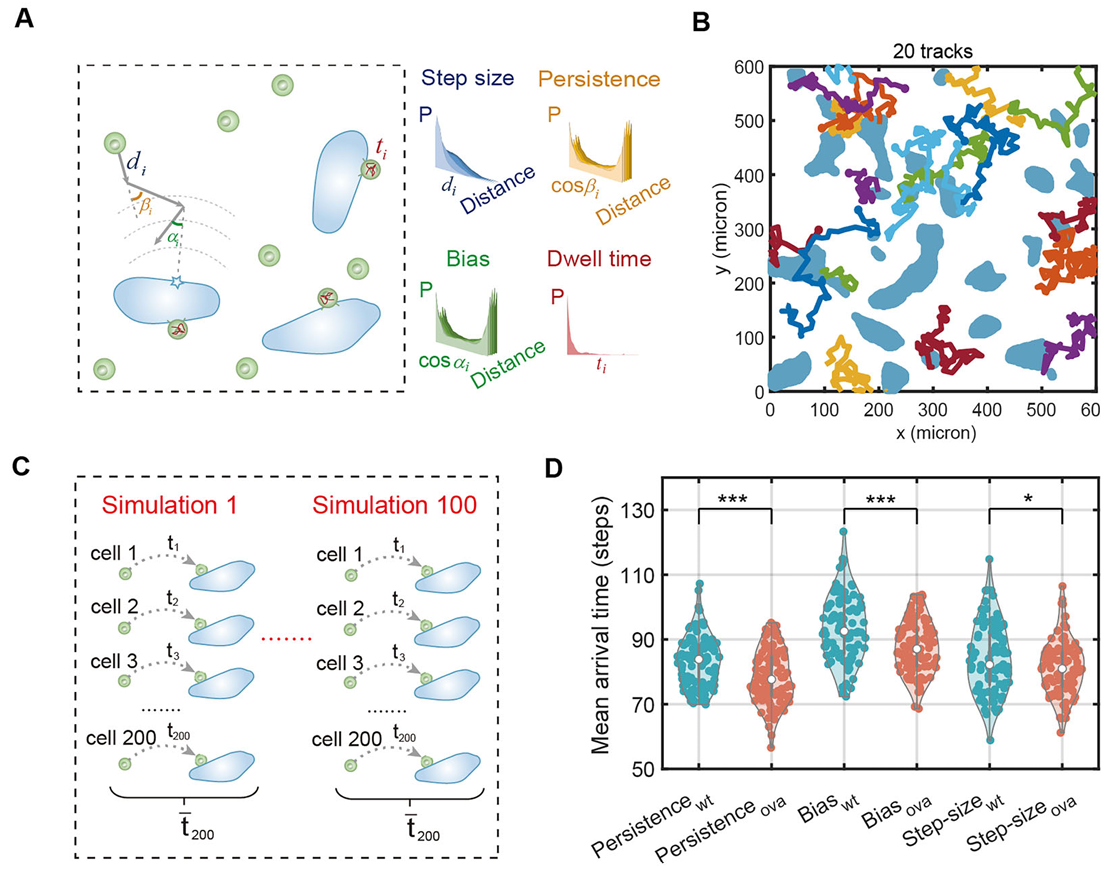
图4 计算模拟揭示T细胞搜寻策略与聚集的关键机制
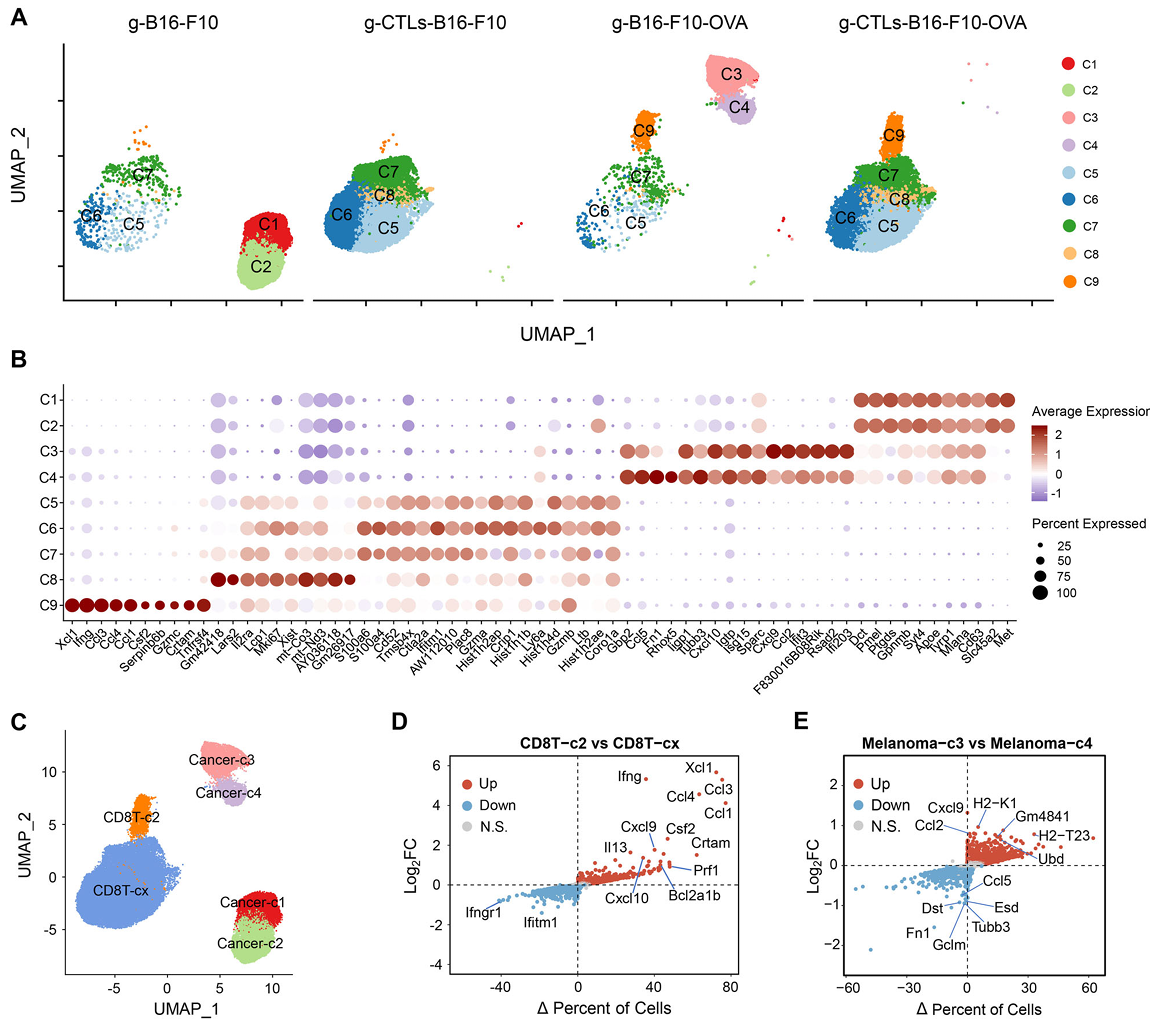
图5 单细胞测序分析揭示肿瘤异质性及耐受机制

图6 文章上线截图(全文链接:https://doi.org/10.1002/2056-4538.70033)
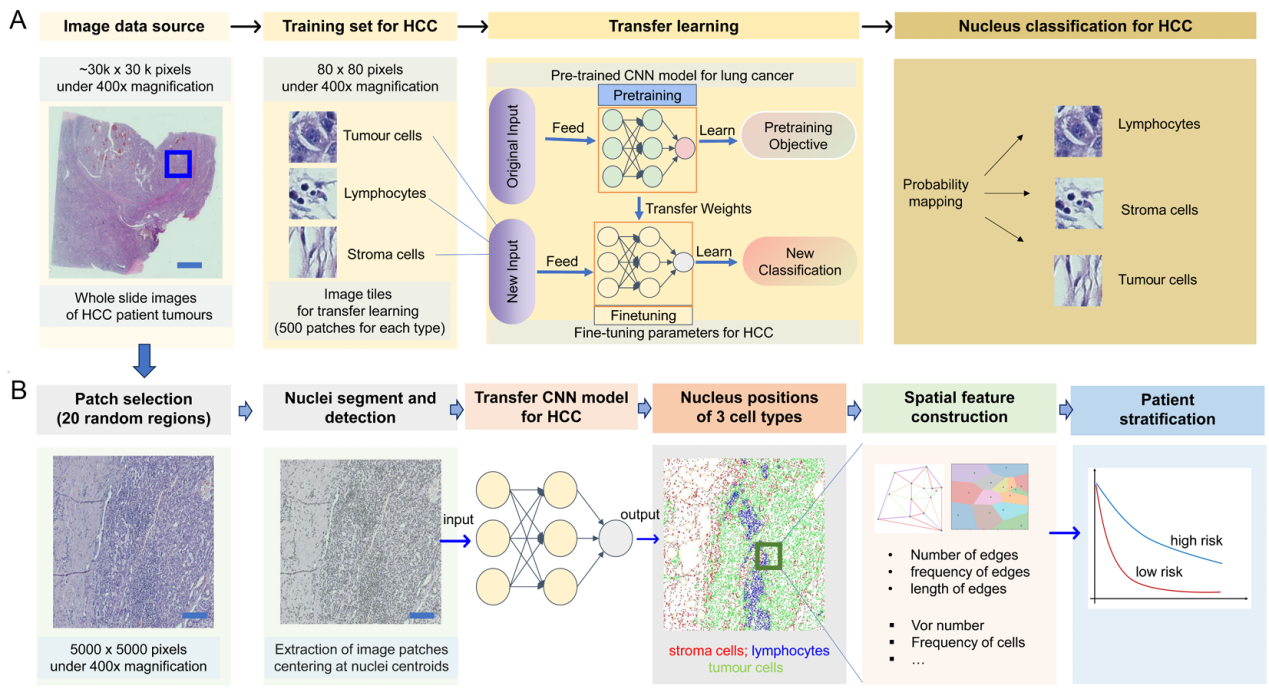
图7 图像数据处理流程
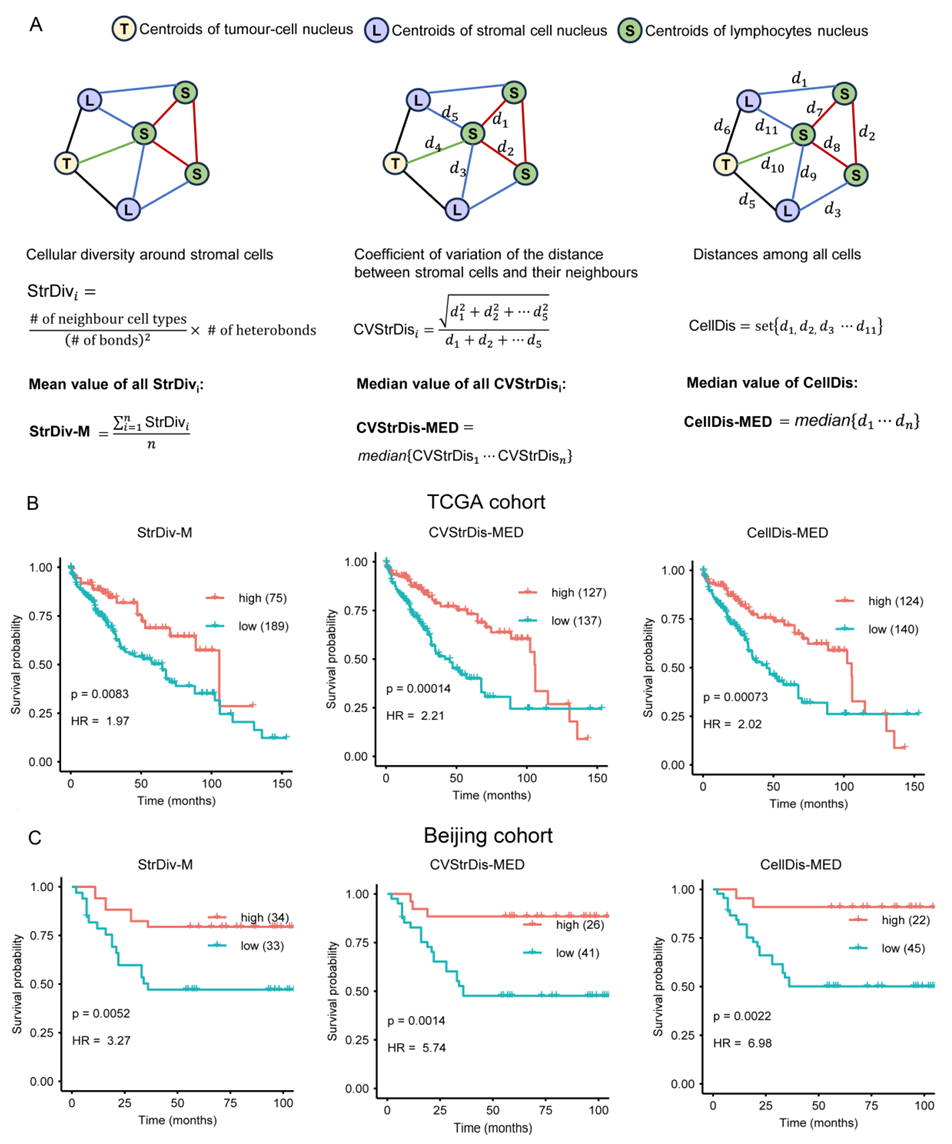
图8 三个重要空间特征的患者分层功效
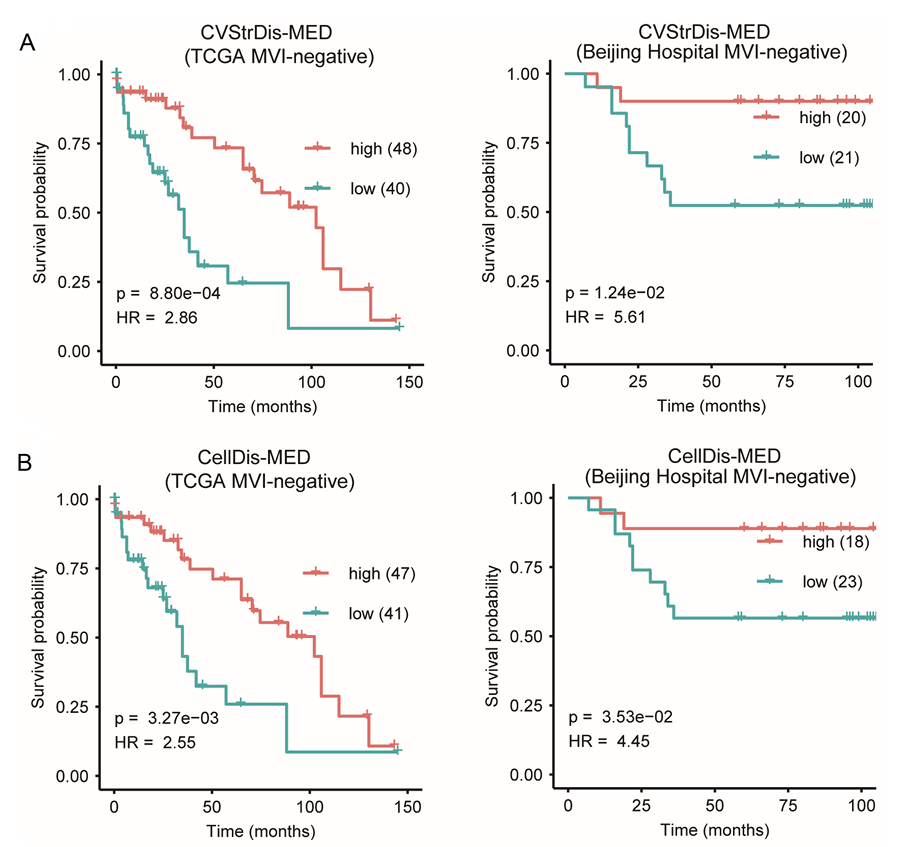
图9 使用空间特征和 MVI对北京医院队列患者的疗效进行组合分析
附件下载: