ACS Nano | 黑磷调控胰腺癌肿瘤相关成纤维细胞活化
近日,中国科学院深圳先进技术研究院材料界面研究中心耿胜勇团队利用空间多组学揭示了黑磷对胰腺癌中癌相关成纤维细胞异质性的重塑作用,成功对黑磷抗胰腺癌的生物学功能进行了全面解析。相关成果在纳米领域国际权威期刊ACS Nano上发表题为“Effect of Bioactive Black Phosphorus Nanomaterials on Cancer-Associated Fibroblast Heterogeneity in Pancreatic Cancer”的研究论文。
中国科学院深圳先进技术研究院喻学锋研究员和耿胜勇副研究员、广东医科大学附属东莞第一医院郑彪主任为本文共同通讯作者,北京大学深圳医院曲建华博士和严子龙博士为本论文第一作者。

原文链接:https://doi.org/10.1021/acsnano.4c06147
胰腺癌被称为“癌中之王”,尚无有效的治疗方法。胰腺癌之所以对化疗、靶向疗法和免疫治疗等疗法具有明显的抵抗性,主要是由于其独特的肿瘤微环境——致密的间质。肿瘤相关成纤维细胞(CAFs)在胰腺癌进展中发挥关键作用,以CAFs为靶标的间质治疗已成为胰腺癌治疗领域的研究热点。因此,开发新型的CAFs候选药物并阐明其作用机制具有重要的科学意义和临床应用价值。随着纳米技术的快速发展,各类新型纳米材料为癌症的治疗提供了新思路和新方法。解析纳米材料的内在生物学效应及分子靶点,有望为靶向CAFs的胰腺癌治疗带来新的机遇。
中国科学院深圳先进技术研究院材料界面研究中心是国际上最早开始黑磷生物应用研究的团队之一,在国际上率先揭示了黑磷的细胞内降解机制以及所诱发的生物学效应(Angew. Chem. Int. Ed. 2019,58,769-774;Nat. Nanotechnol. 2021,16,1150-1160)。近年来,耿胜勇团队通过构建肝癌、乳腺癌、胰腺癌、白血病等原位肿瘤小鼠模型,系统揭示了黑磷的抗肿瘤生物学作用机制(Adv. Sci. 2024,11,2305762;J. Control. Release 2023,354,889-901;Chem. Eng. J. 2021,421,127879;Theranostics 2020,10,4720-4736)。
基于上述研究基础,本工作深入开展了黑磷影响胰腺癌CAFs的机制研究。在KPC小鼠模型中,利用空间转录组学、生物信息学和分子生物学等科学手段阐明了黑磷对胰腺肿瘤微环境和CAFs异质性的影响。研究结果表明,黑磷通过消耗炎症细胞CAFs(iCAFs)和肌成纤维细胞CAFs(myoCAFs)两种CAFs亚型重塑胰腺肿瘤微环境,从而抑制肿瘤进展和肝转移。
本研究不仅为开发一种基于CAFs靶点的新型胰腺癌治疗策略奠定科学基础,也将为众多纳米材料的生物应用开辟新方向。
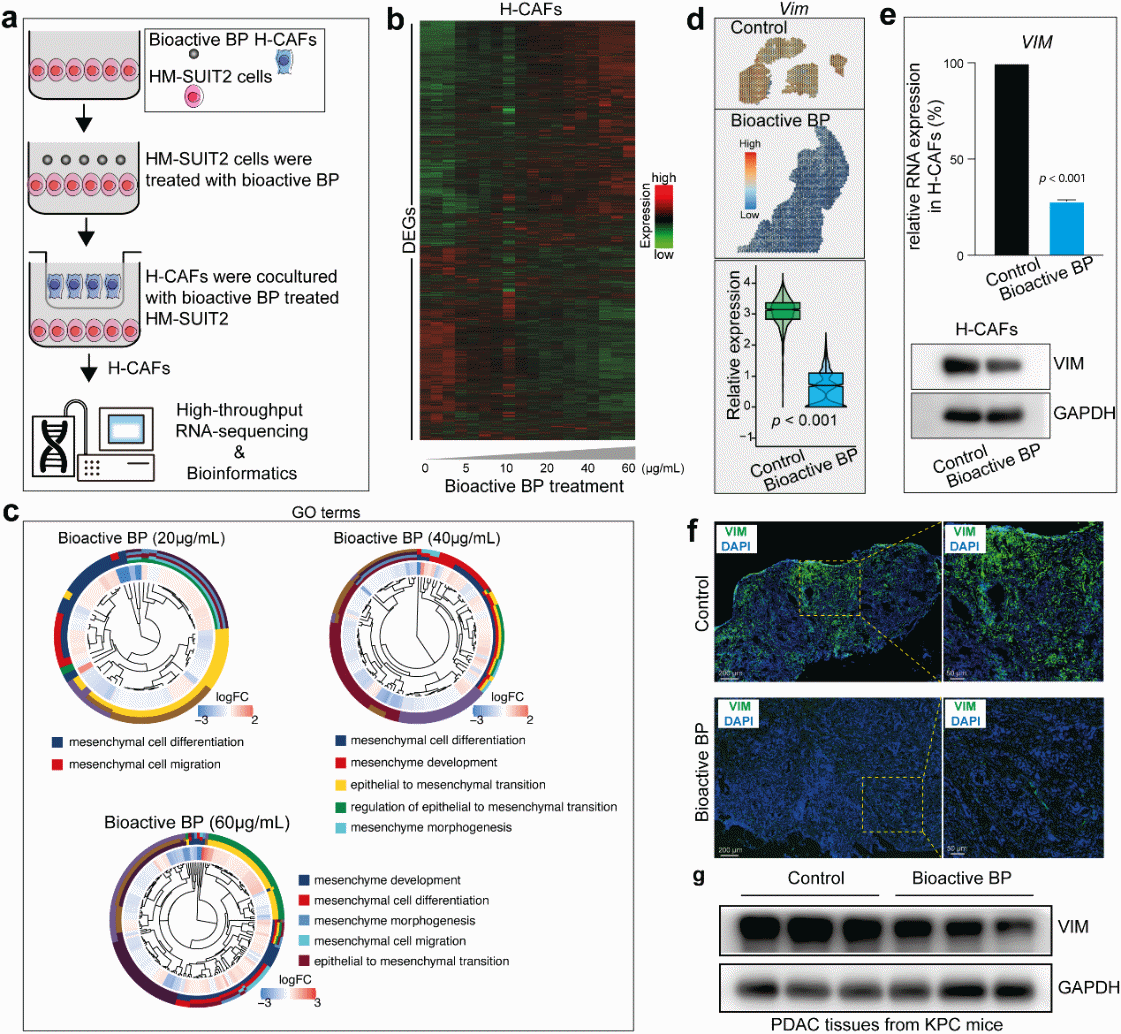
生物活性黑磷通过肿瘤-基质相互作用抑制CAF间充质表型。
该研究工作得到了深圳市医学研究专项资金、科技部国家重点研发计划、国家自然科学基金等项目资助。




