Nature Communications | 哺乳动物活细胞内可编程重构RNA调控网络的人工基因线路
单细胞技术的飞速发展和各类细胞图谱计划的进行,为解析多重时空维度下的细胞类型和状态提供了丰富的分子标签。RNA作为决定细胞类型和细胞状态多样性的核心介质,其表达失调或突变可导致各种病变细胞状态的演化,包括肿瘤的发生。
然而,目前技术大都止步于RNA检测或示踪,无法直接将RNA变化信号转化为对细胞状态的调控信号。最新的RNA传感器eToehold switch、ADAR switch虽然弥补了RNA浓度感应领域的空白,但尚不能灵活地感应点突变,并存在可设计性差、脱靶毒性等问题。
10月10日,中国科学院深圳先进技术研究院合成生物学研究所娄春波课题组与清华大学生命科学学院吴琼课题组合作,在Nature Communications上发表动态感知和激活任意RNA表达的基因线路的最新研究成果,题为“High-resolution and programmable RNA-IN and RNA-OUT genetic circuit in living mammalian cells”。

文章上线截图
该工作通过在哺乳动物活细胞内构建具有感应及响应功能的RNA-IN/RNA-OUT基因线路,实现任意内源RNA调控网络的重构;且具备活细胞内RNA序列点突变的感知能力,首次将单点突变感知能力由1.5倍提升至94倍;在干细胞分化状态感知、细胞内源性孕激素合成代谢途径激活和肿瘤细胞点突变识别和选择性消杀等多种细胞治疗与基因治疗场景中展示出了广泛的应用潜力,为细胞命运的精准操控提供了全新的工具箱。
如何在活细胞中精准、高效、可编程地感应广谱RNA浓度和序列的动态变化,并对特定的靶细胞进行调控操纵仍是生命科学和医药领域面临的关键挑战。
本研究提出一种新策略,旨在开发活细胞内高灵敏、可编程、单核苷酸分辨率的RNA感应及响应基因线路,命名为RNA-IN/RNA-OUT。该线路主要包括三个模块:上游负责内源RNA输入的RNA识别感知模块(实现RNA-IN)、下游负责内源RNA表达输出的效应模块(实现RNA-OUT),以及负责RNA信息呈递的处理模块(图1)。
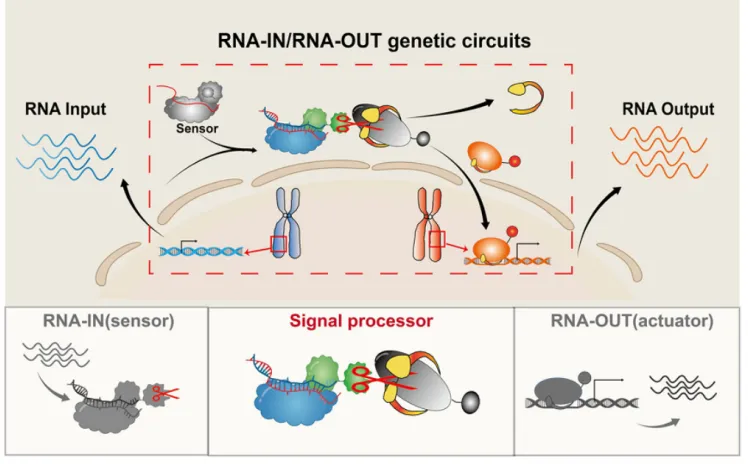
图1. RNA-IN/RNA-OUT工作原理示意图
研究团队首先通过“识别-激活”的策略构建了一个可编程的RNA传感器,命名为CASP传感器,发挥RNA动态信号的感知功能,构成RNA-IN模块。CASP传感器包含可编程的RNA结合蛋白(DiCas7-11)和效应蛋白(转录激活因子CI434及激活域VP64)两个部分。CASP传感器跟随crRNA引导激活蛋白酶活性,释放锚定在细胞膜的效应蛋白,达到转录调控的目的。在精密设计的基础上,为了实现对广谱RNA的灵敏感应,研究团队系统地调试与优化了CASP 传感器中的各个元件,成功检测到内源表达低至8个转录本每百万条转录本(TPM)(图2)。
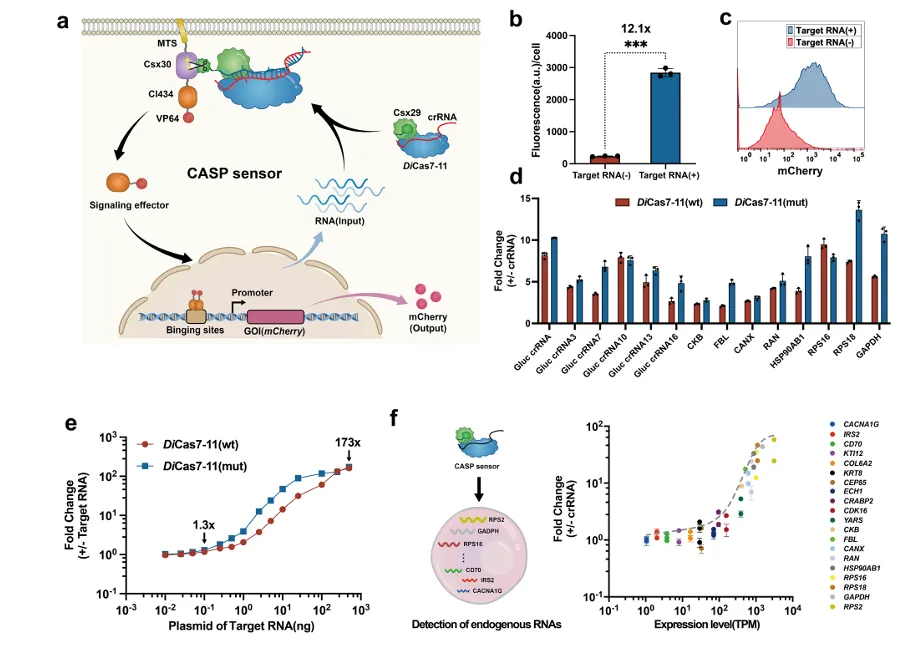
图2. 可编程CSAP传感器的设计与表征(RNA-IN)
除了RNA的表达异常,基因突变亦是导致癌症、血管、神经性疾病等体细胞病变的重要原因。但野生型与突变型RNA序列之间往往仅有单个核苷酸突变的微小差异,难检测也对RNA-IN模块的感应分辨率提出了更具挑战性的要求。然而,CASP传感器中,RNA感应关键元件“DiCas7-11”对单碱基突变有较高的容忍度,不足以实现单点突变的检测。
研究团队系统地探索了DiCas7-11对碱基错配的容忍临界点,通过引入辅助突变位点的协同策略,在crRNA与目标RNA序列之间形成单碱基错配差,首次将原本不可检测的单点突变RNA感应由1.5倍提升至94倍。由此,成功实现单碱基突变的检测,也将RNA表达量的感应扩展至序列变化的感应,极大地丰富了RNA-IN模块的识别范围。特别是在肿瘤关键基因KRAS、TP53、BRAF、PIK3CA、EGFR等代表性点突变的检测中,CASP感应器展示出灵敏的识别能力(图3)。
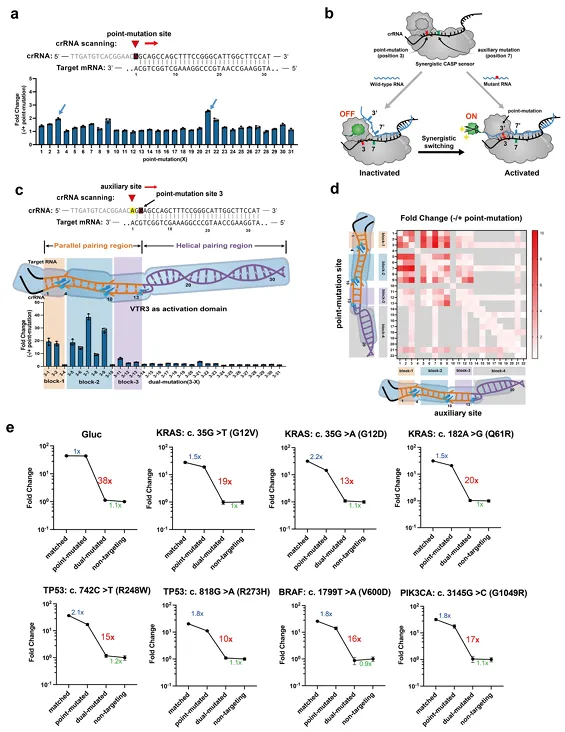
图3. 协同性CASP传感器对单核苷酸突变的感应与响应(RNA-IN)
进一步地,研究团队将CASP传感器(RNA-IN)与可编程的dSpCas9-VPR内源性激活器(RNA-OUT)连接,以构成完整的RNA-IN/RNA-OUT基因线路。利用该基因线路对细胞内不同表达水平的RNA感应,及受环境因素刺激时细胞内部动态变化RNA的感应,最终实现了特定基因的转录激活(图4)。
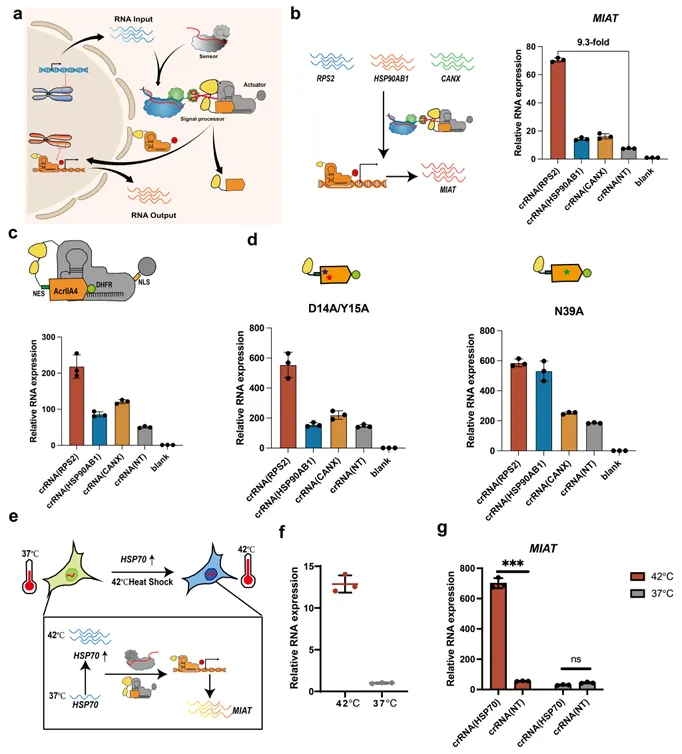
图4. RNA-IN/RNA-OUT基因线路的设计与优化
最后,研究团队在不同的细胞类型中充分展示了RNA-IN/RNA-OUT基因线路对内源性RNA的超敏感知和灵活操纵能力,包括:(1)连接持续表达的RNA以激活孕酮的内源性生物合成代谢网络;(2)动态监测细胞分化和转分化的细胞状态变化;(3)识别特征点突变的RNA选择性杀死胰腺癌和肝癌细胞(图5)。
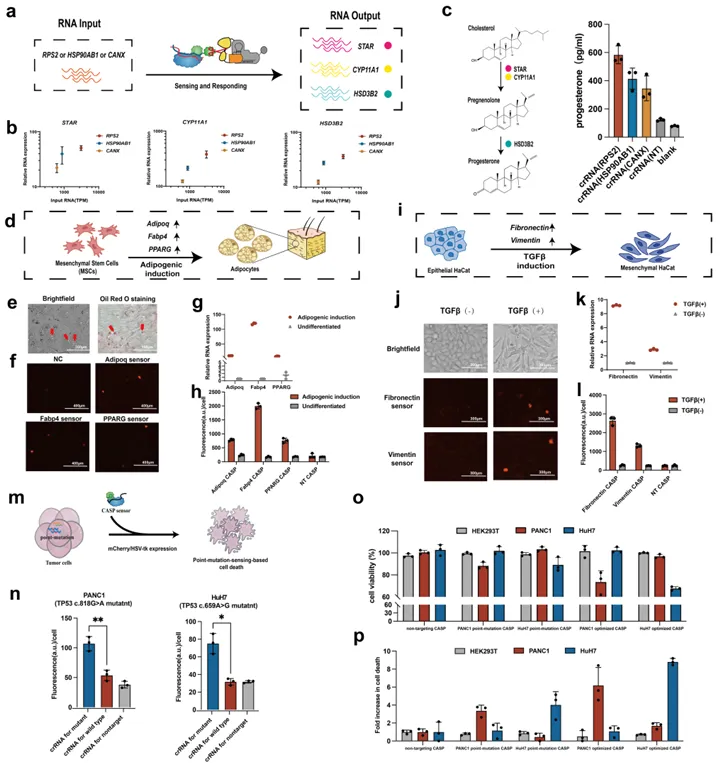
图5. RNA-IN/RNA-OUT基因线路的应用拓展
综上所述,RNA-IN/RNA-OUT基因线路具有高灵敏、可编程、单碱基分辨率的特点;该线路在活细胞内感应RNA动态变化并直接转换为特定基因的转录调控指令,在任意的RNA之间建立强关联,有潜力重构细胞内部RNA调控网络,赋予细胞新的生物学功能。该线路在细胞与基因治疗、细胞重编程以及化合物的生物合成等领域拥有广泛的应用前景,为细胞命运的操纵提供了革新性的技术支持。
清华大学张敏博士、张雪博士为共同第一作者,娄春波研究员和吴琼副教授为文章共同通讯作者,清华大学博士生许永跃、张博和中国科学院深圳先进技术研究院项延会博士做成了重要贡献。该研究得到了科学技术部、国家自然科学基金、中国科学院和清华大学万科公共卫生与健康学科发展专项基金的支持。




