Nature Communications | 5T糖原成像揭示人体肌糖原多模式代谢奥秘
近日,医学成像科学与技术系统全重实验室骨干、中国科学院深圳先进技术研究院劳特伯生物医学成像研究中心周洋副研究员研究团队在Nature Communications上发表了题为 “In vivo imaging of glycogen in human muscle” 的原创研究成果[1]。
该研究通过全身超高场磁共振成像平台 uMR Jupiter 5T 开发的糖原 rNOE 成像方法(glycoNOE,relayed nuclear Overhauser effect in glycogen),成功实现了人体骨骼肌糖原的高分辨成像,揭示了运动后肌肉糖原消耗和补充过程中的复杂模式,展示了 glycoNOE MRI 在能量代谢机制探索中的应用前景。审稿人公开评价:“人体糖原的空间测量是革命性的(revolutionary)。”文章的第一作者为中国科学院深圳先进技术研究院的别崇雪博士,通讯作者为周洋。主要合作者来自约翰斯·霍普金斯大学、厦门大学和利物浦约翰摩尔大学。
研究背景
肌糖原(muscle glycogen)是人体能量储存的主要形式之一[2]。在健康个体中,静息状态下肌糖原的浓度约为 100 mM(按葡萄糖分子计算)[3]。肌糖原通过分解,为骨骼肌收缩提供三磷酸腺苷(adenosine triphosphate,ATP),满足持续活动的能量需求,其代谢速率与运动强度和持续时间密切相关[4]。肌糖原的利用和储存呈现显著的空间异质性,既表现为不同肌群之间的差异[5],也涉及亚细胞水平的分布特征[6]。上世纪 80-90 年代,Shulman 等人提出的 ¹³C 磁共振波谱(magnetic resonance spectroscopy,MRS)技术,解决了人体糖原“看不到”的问题,是糖原在体检测的重要手段[7]。然而,该方法在分辨率、灵敏度及硬件要求方面存在一定局限性。2019 年,周洋等人在PNAS提出利用饱和转移磁共振实验中的中继核奥氏效应(relayed nuclear Overhauser effect,rNOE)[8] 实现糖原信号放大(命名为 glycoNOE),为高分辨率、高灵敏度成像糖原代谢开辟了新途径[9] 。近日发表的研究,利用 glycoNOE MRI 技术,在人体上实现了肌糖原的高时空分辨率成像,部分解决人体糖原“看不清”的问题,展示了人体骨骼肌局部的糖原代谢特征。在运动后骨骼肌中,发现了三种独特的肌糖原恢复模式,为人体肌糖原代谢调控带来了新认知。
文章上线截图
研究方法与结果
主要发现 ①:5T 环境下高时空分辨的人体骨骼肌糖原测量方法的建立
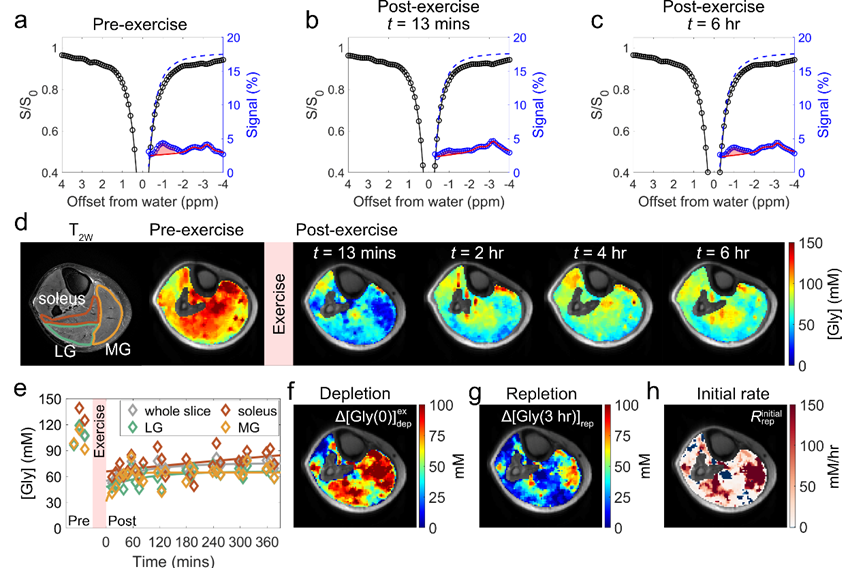
该研究在 5T 磁共振环境开发了一套基于 glycoNOE MRI 的人体肌糖原测量方法,实现了毫米级空间分辨率和分钟级时间分辨率成像。通过模拟人体肌糖原颗粒特性的体外仿体实验(平均粒径 26 nm),确定了糖原信号与浓度的转换关系。随后,研究了静息状态下人体骨骼肌的糖原含量及其分布特征。通过从小腿肌肉的Z谱中移除直接水饱和(Direct water saturation,DS)和磁化转移造影(Magnetization transfer contrast,MTC)的背景信号,残余谱中清晰显示出位于 -1 ppm 的 glycoNOE 信号。采用两阶段多池洛伦兹拟合对 glycoNOE 信号进行定量,并结合仿体校准数据,成功绘制出肌糖原浓度图谱。结果显示,16 名健康受试者的小腿肌糖原分布均匀,平均浓度为 99 ± 13 mM。重复扫描验证了该方法的稳定性和精确性,为进一步探索肌糖原代谢奠定了基础(图 1)。
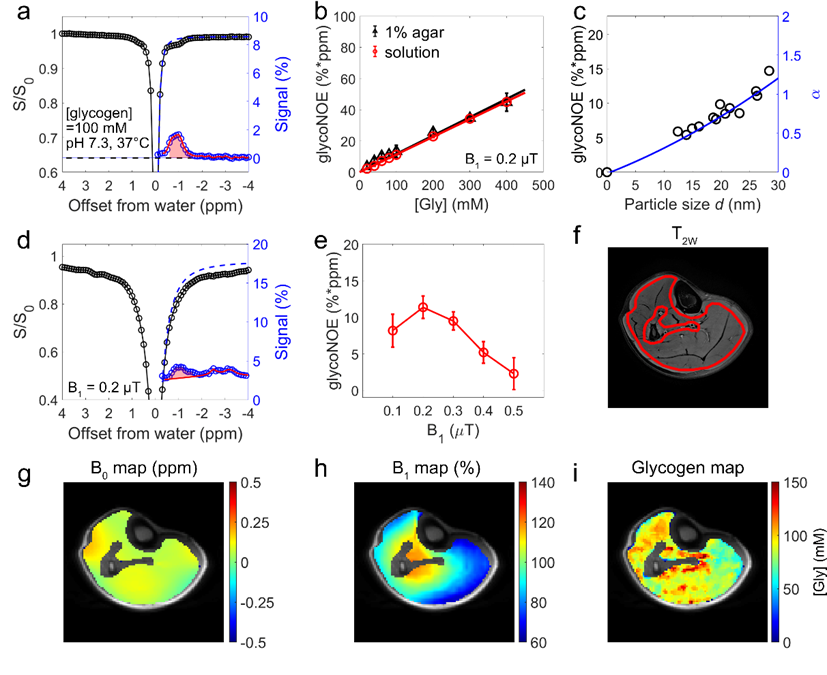
图 1. 5T 磁共振环境下人体骨骼肌糖原的测量主要发现
主要发现②:骨骼肌糖原的消耗和恢复呈现显著局部差异
该研究探讨了不同强度运动引起的肌糖原消耗及运动后恢复的动态变化,其中低强度运动的总机械功为 16 kJ,高强度运动的总机械功为 30 kJ。实验结果显示,运动导致显著的肌糖原耗竭,且在 6 小时恢复期间,肌糖原未能完全回到运动前的基线水平。此外,运动后肌糖原分布不均匀,各肌肉区域的恢复速率也有所不同。例如,在低强度跖屈运动组中,一名受试者的内侧腓肠肌(medial gastrocnemius,MG)区域表现出最为显著的恢复,空间上与糖原明显耗竭区域相对应,而比目鱼肌(soleus)和外侧腓肠肌(lateral gastrocnemius,LG)区域的糖原消耗量较少,恢复较为缓慢。因此,肌糖原代谢具有空间异质性,且糖原的消耗与恢复呈现正相关(图 2)。
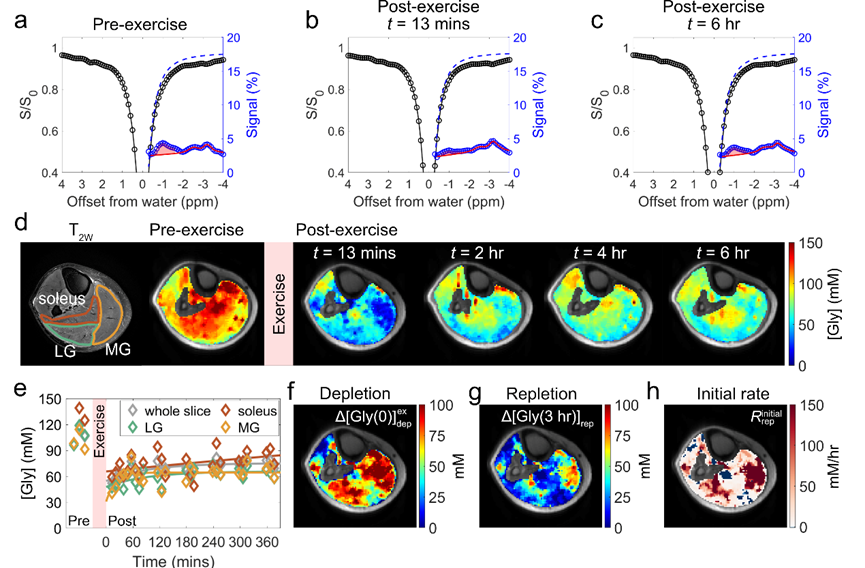
图 2. 低强度跖屈运动前后的小腿肌糖原分布
主要发现 ③:肌糖原恢复具有与肌肉类型无关的三类典型模式
通过对高强度跖屈运动实验数据的深入分析,该研究揭示骨骼肌局部区域的三种糖原恢复动力学模式(图 3):
• 单指数恢复(Type a):糖原水平呈指数方式缓慢增加,但未完全恢复至基线,约占高强度运动后骨骼肌区域的 78 ± 12%。
• 快速恢复后再消耗(Type b):糖原在初始恢复阶段快速恢复至较高水平,随后缓慢下降,约占骨骼肌区域的 14 ± 10%。
• 持续消耗后指数恢复(Type c):初始恢复阶段糖原水平持续下降,随后指数恢复,约占骨骼肌区域的 8 ± 9%。
这三种动力学模式反映了局部糖原代谢的复杂调节机制。值得注意的是,即使在同一块肌肉内(例如比目鱼肌),不同区域的运动后剩余糖原水平可能存在显著差异,并可能同时表现出多种恢复模式(a 型和 c 型)。
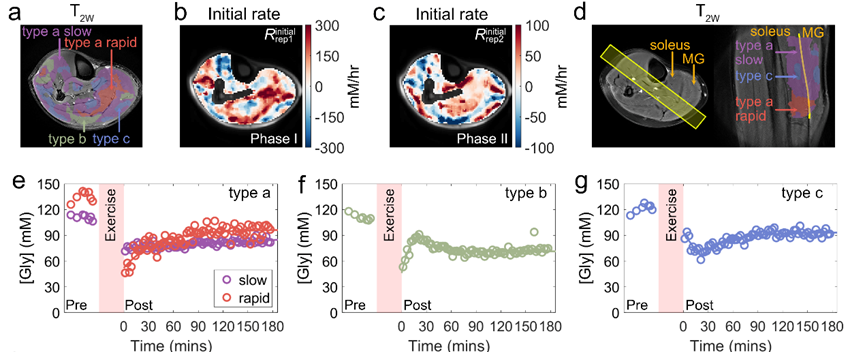
图 3. 高强度跖屈运动后骨骼肌糖原恢复的三种动力学模式
研究展望
本研究建立了一套基于 glycoNOE MRI 测量人体肌糖原的方法,为精细化理解人体糖原代谢机制提供了手段。此方法有望拓展至人体肝糖原成像,在骨骼肌和肝脏中实现更全面的糖原动态监测。未来,此方法也有望帮助临床研究与诊疗,成为评估人体糖代谢紊乱相关疾病的新工具。
此外,通过对肌肉局部的深入分析,该研究揭示了运动后肌糖原合成的空间异质性和时间双期性,并发现了部分区域在恢复期间糖原信号进一步降低,提示糖原磷酸化酶在运动后肌肉局部可能部分处于激活状态,为未来能量代谢调控机制的深入研究指明了新方向。
作者简介
周洋,中国科学院深圳先进技术研究院副研究员、硕导。从事前沿分子磁共振成像理论、技术和应用研究。发展rNOE磁共振信号放大机制模型,受邀在磁共振领域国际权威期刊NMRin Biomedicine撰写rNOE专题型综述文章;提出糖原成像方法,获得国际医学磁共振年会金奖;发现人体肌糖原代谢3型模式,提出基于肌糖原成像的庞贝病评估方法。以第一/通讯作者在PNAS、Nature Communications等玉际权威期刊/会议发表论文10余篇。主持科技部重点研发课题、国家自然科学基金面上项目、深圳市基础研究重点项目。
别崇雪,中国科学院深圳先进技术研究院博士后。主要研究方向为基于饱和转移磁共振(STMRI)的糖代谢成像方法及其应用,以第一作者身份在Nature Communications、Magnetic Resonance in Medicine、NMRin Biomedicine等国际期刊发表论文十余篇,获批国家资助博士后项目。
参考文献
[1] Bie,C.,Ma,Y.,van Zijl,P. C. M.,Yadav,N. N.,Xu,X.,Zheng,H.,Liang,D.,Zou,C.,Areta,J. L.,Chen,L.,& Zhou,Y. (2024). In vivo imaging of glycogen in human muscle. Nature communications, 15(1),10826.
[2] Jue,T.,Rothman,D. L.,Shulman,G. I.,Tavitian,B. A.,DeFronzo,R. A.,& Shulman,R. G. (1989). Direct observation of glycogen synthesis in human muscle with 13C NMR. Proceedings of the National Academy of Sciences of the United States of America, 86(12),4489–4491. [3] Price,T. B.,Rothman,D. L.,Taylor,R.,Avison,M. J.,Shulman,G. I.,& Shulman,R. G. (1994). Human muscle glycogen resynthesis after exercise: insulin-dependent and -independent phases. Journal of applied physiology (Bethesda,Md.:1985), 76(1),104–111.[4] Hargreaves,M.,& Spriet,L. L. (2020). Skeletal muscle energy metabolism during exercise. Nature metabolism, 2(9),817–828.[5] Vigh-Larsen,J. F.,Ørtenblad,N.,Spriet,L. L.,Overgaard,K.,& Mohr,M. (2021). Muscle Glycogen Metabolism and High-Intensity Exercise Performance: A Narrative Review. Sports medicine(Auckland,N.Z.), 51(9),1855–1874. [6] Schytz,C. T.,Ørtenblad,N.,Gejl,K. D.,& Nielsen,J. (2024). Differential utilisation of subcellular skeletal muscle glycogen pools: a comparative analysis between 1 and 15 min of maximal exercise. The Journal of physiology, 602(8),1681–1702. [7] Price,T. B.,Rothman,D. L.,& Shulman,R. G. (1999). NMR of glycogen in exercise. The Proceedings of the Nutrition Society, 58(4),851–859. [8] Zhou,Y.,Bie,C.,van Zijl,P. C. M.,& Yadav,N. N. (2023). The relayed nuclear Overhauser effect in magnetization transfer and chemical exchange saturation transfer MRI. NMR in biomedicine, 36(6),e4778.
[9] Zhou,Y.,van Zijl,P. C. M.,Xu,X.,Xu,J.,Li,Y.,Chen,L.,& Yadav,N. N. (2020). Magnetic resonance imaging of glycogen using its magnetic coupling with water. Proceedings of the National Academy of Sciences of the United States of America, 117(6),3144–3149.