
Trends in Immunology | 李汉杰团队提出并定义“小胶质细胞谱系”
5月13日,中国科学院深圳先进技术研究院的李汉杰团队在Cell Press细胞出版社旗下期刊Trends in Immunology发表了题为 “The Microglial Lineage: Present and Beyond”的论点文章。
基于外周组织中存在具有小胶质细胞特征的免疫细胞的研究进展,该文章提出使用“小胶质细胞谱系”这一术语,统一定义此类细胞和经典中枢神经系统小胶质细胞。小胶质细胞谱系是指具有小胶质细胞分子表型特征,相同胚胎起源的组织驻留免疫细胞,但其组织分布和功能呈现多样性。
中枢神经系统(CNS)小胶质细胞的发现
小胶质细胞的发现是神经生物学领域的里程碑(图1A)。过去一个世纪的研究表明,小胶质细胞是大脑健康的“守护者”,在发育、稳态维持、免疫监视及神经退行性疾病中发挥关键作用。
以词源学角度,“microglia”(希腊语“micro-”意为“微小”)指代胞体较小的胶质细胞。广义的“胶质细胞”(希腊语“glue”,意为“胶水”)概念起源于19世纪中叶,反映早期学界将其视为神经系统的“粘合剂”。尽管“星形胶质细胞”一词于19世纪末被提出,但直到1919年,Pío del Río-Hortega才通过新型染色技术从小胶质细胞和少突胶质细胞中区分出星形胶质细胞,明确定义了具有独特小胞体特征的小胶质细胞。后续研究将视网膜中具有类似形态和染色特征的细胞也归入此范畴。尽管Pío del Río-Hortega从未将小胶质细胞严格限定于CNS,但由于历史研究重点和技术限制,学术界长期认为小胶质细胞仅存在于CNS。
外周类小胶质细胞的发现
单细胞基因组学以前所未有的精度揭示了细胞多样性,改变了生物学的传统研究范式。它能够以单细胞和转录组分辨率进行跨组织比较,重新定义对细胞亚群定义的理解,挑战了长期以来认为某些细胞具有严格组织特异性的观念。此外,单细胞基因组学技术、先进的计算生物学技术,和时间分辨率采样技术相结合,有望揭示人类和其它不常见物种中不同细胞类型的个体发育。
基于单细胞测序技术,近期在人类及非啮齿类动物外周组织中发现,与CNS小胶质细胞具有相同转录组、表观遗传特征和相同卵黄囊起源的免疫细胞(图1A)。通过无偏性分析人类胚胎发育不同阶段的多个器官/组织单细胞转录组数据,作者团队及其他研究者发现:在胎儿皮肤、睾丸、心脏及外周神经系统(PNS)中,存在一类具有小胶质细胞转录组特征(表达P2RY12、SALL1、TMEM119,不表达MRC1、DAB2、LYVE1)的免疫细胞群。流式细胞术及免疫组化进一步证实,此类细胞为CD45lowMRC1-P2RY12+,与CNS小胶质细胞高度相似,而非其他组织定居巨噬细胞。稳态下,它们呈现典型分支状形态(胞体延伸出树突状结构)。时序性单细胞转录组联合原位免疫荧光染色表明,这些外周类小胶质细胞与其CNS对应物同步出现于神经管发育阶段,并可能起源于卵黄囊巨噬细胞祖细胞。表观遗传分析进一步显示,PNS类小胶质细胞与CNS小胶质细胞具有相同特征。综上,这些外周类小胶质细胞与CNS小胶质细胞共享转录组、蛋白标记、形态、表观遗传及胚胎起源(图1A)。
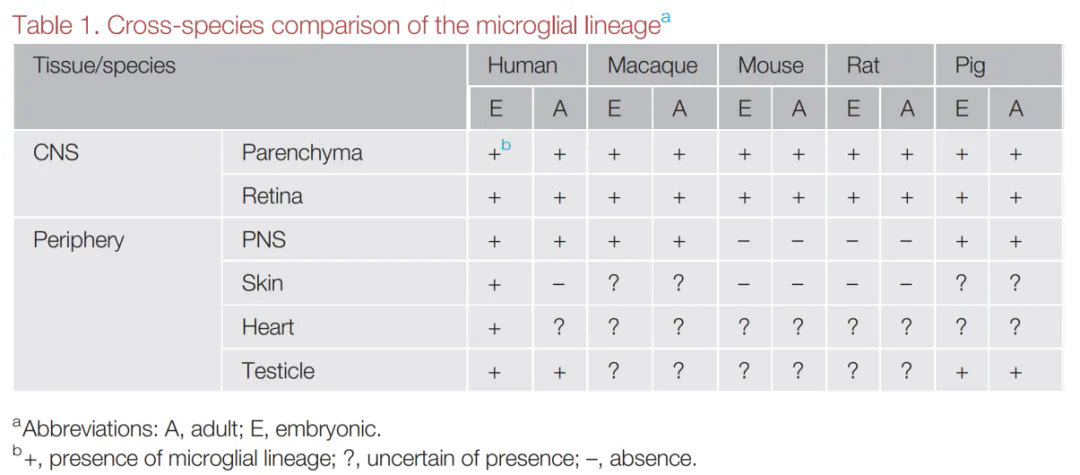
小胶质细胞谱系:具有小胶质细胞分子表型与胚胎起源的组织驻留免疫细胞
尽管Pío del Río-Hortega的早期研究聚焦于CNS,但其染色技术主要针对神经组织,限制了对外周区域的探索。后续啮齿类动物研究(小鼠和大鼠)强化了“小胶质细胞仅存于CNS”的观点。然而,近期单细胞基因组学研究在人类及非啮齿类外周组织中发现了与小胶质细胞具有相同分子特征及卵黄囊起源的细胞(Table 1)。这些发现挑战了传统认知,表明小胶质细胞谱系是一类分布广泛且具有器官特异性功能的独特免疫谱系(图1B)。
文章提出使用“小胶质细胞谱系”统一指代CNS小胶质细胞及其外周同类细胞。该术语强调此类细胞共享小胶质分子表型与胚胎起源,代表一类广泛分布的定居免疫细胞(图1B)。这一命名方案符合现代细胞分类学原则,可避免术语混淆,并促进跨器官比较研究。
1. 符合现代细胞分类学:传统细胞分类依赖有限标记物(如IBA1)和形态特征,而单细胞技术可基于分子与发育特征进行无偏分类。将组织定居巨噬细胞亚群纳入“小胶质细胞谱系”,体现了以发育关系和分子状态为核心的分类原则。
2. 避免术语混淆:“类小胶质细胞”一词常被误用于iPSC衍生模型、单核细胞来源的CNS浸润细胞或仅表达部分小胶质相关基因(如TREM2、CX3CR1)的外周巨噬细胞。而通过多组学分析和跨组织比较鉴定的外周小胶质细胞谱系,在分子与发育层面与CNS小胶质细胞同源。将其归入“小胶质细胞谱系”可明确其生物学独特性。基于其与神经系统的关联,作者建议将PNS类小胶质细胞命名为“PNS小胶质细胞”。
3. 促进跨器官比较:小胶质细胞谱系在CNS中调控突触修剪等神经功能的分子机制,可能在外周被“改造”用于调控神经嵴细胞分化或神经元成熟。统一命名有助于揭示该谱系在不同组织中的保守与特化功能。
外周小胶质细胞谱系的功能意义
外周小胶质细胞谱系在不同组织(包括胎儿皮肤、睾丸、心脏和周围神经系统)中表现出显著的多样性空间分布(图1B)。它代表着一个多样化的驻留巨噬细胞群,这些巨噬细胞在不同器官中发挥着特殊作用,它们源于胚胎但又适应于不同的组织微环境。在胎儿皮肤中,小胶质细胞谱系分布于表皮,并与神经嵴细胞发生物理相互作用,促进神经嵴细胞分化为黑素细胞前体。在睾丸中,它们在发育和成年期聚集于睾丸的输出管和附睾管周围。在心脏中,它们在发育过程中主要定位于心脏的主动脉壁。它们在睾丸和心脏中的功能仍在研究中。在感觉神经节(例如背根神经节,DRG)和交感神经节(SG)内,PNS小胶质细胞将神经元胞体包裹在由卫星胶质细胞 (SGC) 形成的膜内,与神经元胞体形成直接的物理界面。这些相互作用通过调节神经元胞体增大和轴突生长,对神经元成熟至关重要。PNS小胶质细胞的缺失会损害神经元的兴奋性和躯体感觉。多样化的组织分布和功能凸显了小胶质细胞谱系细胞对其微环境的适应性及其在组织发育和体内平衡中的关键作用(图1B)。
未来研究展望
为了全面了解小胶质细胞谱系,在未探索的组织、发育阶段和物种中鉴定新的亚群至关重要。跨物种比较研究至关重要,因为小鼠和大鼠中缺乏关键亚群(例如皮肤和PNS中的亚群)。通过对不同物种不同组织中小胶质细胞的存在进行系统发育分析,不仅可更好地理解小胶质细胞谱系的进化保守性和分化性,而且还可揭示进化和发育压力如何塑造小胶质细胞谱系在不同生态位中的可塑性。进一步阐明组织微环境如何塑造它们的表型和功能,将有助于阐明它们对不同组织体内平衡的贡献。由于CNS小胶质细胞参与不同的病理状况,而探索外周小胶质细胞谱系是否以及如何在男性不育、心血管疾病和周围神经病变等疾病中发挥作用,值得未来关注。填补这些研究空白将加强小胶质细胞谱系的进化多样性、组织共同和特异适应性及其与人类疾病相关性的理解。
本文提出“小胶质细胞谱系”这一术语,以整合中枢神经系统与外周组织中具有相同小胶质细胞分子特征及发育起源的免疫细胞。这一分类方案旨在减少术语混淆、促进跨学科研究,并强调其进化连续性。但是最终该术语的适用性,需经科学界广泛讨论与共识确认。该研究获国家自然科学基金、深圳市医学研究专项资金、国家科技部重点研发计划、深圳市科技计划,以及深圳合成生物学创新研究院科研计划等多个项目的支持。

文章上线截图

图1. 小胶质细胞谱系是指包含小胶质细胞转录组和相同发育的免疫细胞。(A) 时间轴展示了小胶质细胞谱系的发现历史。(B) 示意图展示了小胶质细胞谱系在人类中的发育起源、组织分布和功能。
附件下载: